
心理学的依存
Psychological dependence

☆ 心理的依存(Psychological dependence) は、認知障害の一種であり、長期にわたる薬物使用や特定の反復行動の停止に伴い、感情的・動機的な離脱症状が現れる依存の形態である。[4] 特定の物質や行動に一貫して頻繁にさらされることで心理的依存が誘発され、負の強化によって引き起こされる不快な離脱症候群の発症を防ぐために継続的な関 与が必要となる。[5][6] 神経細胞の逆適応は、神経伝達物質の活動の変化や受容体の発現の変化を通じて離脱症状の発生に関与していると考えられている。[5][6][7] 環境の充実や身体活動は、離脱症状を緩和することが示されている。[6]
| Psychological dependence
is a cognitive disorder and a form of dependence that is characterized
by emotional–motivational withdrawal symptoms upon cessation of
prolonged drug use or certain repetitive behaviors.[4] Consistent and
frequent exposure to particular substances or behaviors is responsible
for inducing psychological dependence, requiring ongoing engagement to
prevent the onset of an unpleasant withdrawal syndrome driven by
negative reinforcement.[5][6] Neuronal counter-adaptation is believed
to contribute to the generation of withdrawal symptoms through changes
in neurotransmitter activity or altered receptor expression.[5][6][7]
Environmental enrichment and physical activity have been shown to
attenuate withdrawal symptoms.[6] |
心
理的依存は、認知障害の一種であり、長期にわたる薬物使用や特定の反復行動の停止に伴い、感情的・動機的な離脱症状が現れる依存の形態である。[4]
特定の物質や行動に一貫して頻繁にさらされることで心理的依存が誘発され、負の強化によって引き起こされる不快な離脱症候群の発症を防ぐために継続的な関
与が必要となる。[5][6]
神経細胞の逆適応は、神経伝達物質の活動の変化や受容体の発現の変化を通じて離脱症状の発生に関与していると考えられている。[5][6][7]
環境の充実や身体活動は、離脱症状を緩和することが示されている。[6] |
| Symptoms Psychological withdrawal symptoms include:[4][7][8] Anhedonia Anxiety Changes in appetite Craving for responsible stimulus Dysphoria Exhaustion Insomnia / Hypersomnia Irritability Panic attack Stress |
症状 心理的離脱症状には、次のようなものがある[4][7][8]。 快感の喪失 不安 食欲の変化 責任ある刺激への渇望 不快感 疲労 不眠症/過眠症 過敏 パニック発作 ストレス |
| Development Psychological dependence develops through consistent and frequent exposure to a stimulus. After sufficient exposure to a stimulus capable of inducing psychological dependence (e.g., drug use), an adaptive state develops that results in the onset of withdrawal symptoms that negatively affect psychological function upon cessation of exposure.[4] While psychological dependence is commonly associated with prolonged drug use, it can also manifest through certain behaviors. Psychostimulants (e.g., amphetamine) are a class of drugs that induce only psychological withdrawal symptoms in dependent users.[4][9][10] Behaviors such as excessive exercise can lead to exercise dependence in both amateur and professional athletes, where cognitive withdrawal symptoms—such as anxiety and irritability—arise during periods of abstinence and often correlate with the duration of abstinence.[8][6] Other behaviors that can produce observable psychological withdrawal symptoms (i.e., cause psychological dependence) include shopping, sex and self-stimulation using pornography, and eating food with high sugar or fat content, among others.[6] The process responsible for the induction of psychological dependence is a negative feedback mechanism that involves neuronal-counter adaptation, leading to tolerance to the desirable effects of certain drugs or stimuli and a subsequent withdrawal syndrome upon abrupt cessation of exposure.[5][7] While psychological dependence and addiction are distinct disease states mediated by opposite modes of reinforcement, they arise through partially overlapping biological processes.[5][7] In the nucleus accumbens, both conditions involve overlapping signaling cascades that diverge at the CREB transcription factor. Upregulation of CREB expression in the nucleus accumbens plays a major role in mediating psychological dependence by inhibiting reward-related motivational salience, which mediates the onset of emotional-motivational withdrawal symptoms.[5][10] Evidence indicates that the unpleasant nature of these withdrawal symptoms intensifies the desire to resume the associated drug or behavior.[5] |
発達 心理的依存は、刺激に一貫して頻繁にさらされることで発達する。心理的依存を誘発する刺激(薬物使用など)に十分にさらされると、その刺激の暴露が中止されると心理機能に悪影響を及ぼす離脱症状が現れる適応状態が発達する。[4] 心理的依存は、一般的に薬物の長期使用と関連しているが、特定の行動によっても現れることがある。心理刺激薬(例:アンフェタミン)は、依存症患者に心理 的離脱症状のみを引き起こす薬物のクラスです。[4][9][10] 過剰な運動などの行動は、アマチュアおよびプロのアスリートにおいて運動依存症を引き起こす可能性があり、認知的離脱症状(例:不安や irritability)が離脱期間中に生じ、離脱期間と相関することが多い。[8][6] 観察可能な心理的離脱症状(すなわち、心理的依存を引き起こす)を引き起こすその他の行動には、買い物、ポルノを用いた性行為や自己刺激、糖分や脂肪分の 多い食品の摂取などが挙げられる。[6] 心理的依存の誘発に関与するプロセスは、神経細胞の逆適応を伴う負のフィードバックメカニズムであり、特定の薬物や刺激の望ましい効果に対する耐性が生 じ、曝露を突然中止すると離脱症候群が現れる。[5][7] 心理的依存と依存症は、強化の異なるモードを介して媒介される異なる疾患状態であるが、部分的に重なる生物学的プロセスを通じて発生する。[5][7] 腹側被蓋核では、両方の状態はCREB転写因子で分岐する重なるシグナル伝達カスケードを伴う。腹側被蓋核におけるCREBの発現の上昇は、報酬に関連す る動機付けの重要性を抑制することで心理的依存を仲介する主要な役割を果たし、これにより感情的・動機付け的な離脱症状の発症が仲介される。[5] [10] これらの離脱症状の不快な性質が、関連する薬物や行動を再開したいという欲求を強化する証拠がある。[5] |
| Biomolecular mechanisms Two factors have been identified as playing pivotal roles in psychological dependence: the neuropeptide "corticotropin-releasing factor" (CRF) and the gene transcription factor "cAMP response element binding protein" (CREB).[5] The nucleus accumbens (NAcc) is one brain structure that has been implicated in the psychological component of drug dependence. In the NAcc, CREB is activated by cyclic adenosine monophosphate (cAMP) immediately after a high and triggers changes in gene expression that affect proteins such as dynorphin;[10] dynorphin peptides reduce dopamine release into the NAcc by temporarily inhibiting the reward pathway.[10] A sustained activation of CREB thus forces a larger dose to be taken to reach the same effect.[10] In addition, it leaves the user feeling generally depressed and dissatisfied, and unable to find pleasure in previously enjoyable activities, often leading to a return to the drug for another dose.[11] In addition to CREB, it is hypothesized that stress mechanisms play a role in dependence. Koob and Kreek have hypothesized that during drug use, CRF activates the hypothalamic–pituitary–adrenal axis (HPA axis) and other stress systems in the extended amygdala. This activation influences the dysregulated emotional state associated with psychological dependence. They found that as drug use escalates, so does the presence of CRF in human cerebrospinal fluid. In rat models, the separate use of CRF inhibitors and CRF receptor antagonists both decreased self-administration of the drug of study. Other studies in this review showed dysregulation of other neuropeptides that affect the HPA axis, including enkephalin which is an endogenous opioid peptide that regulates pain. It also appears that μ-opioid receptors, which enkephalin acts upon, is influential in the reward system and can regulate the expression of stress hormones.[12] Increased expression of AMPA receptors in nucleus accumbens MSNs is a potential mechanism of aversion produced by drug withdrawal.[13] |
生体分子メカニズム 心理的依存において重要な役割を果たす2つの要因が特定されている:神経ペプチド「コルチコトロピン放出因子」(CRF)と遺伝子転写因子「cAMP応答 要素結合タンパク質」(CREB)。[5] 脳の構造の一つである腹側被蓋野(NAcc)は、薬物依存の心理的要素に関与していると考えられている。NAccにおいて、CREBは高揚感直後に環状ア デノシン一リン酸(cAMP)によって活性化され、ダイナorphinなどのタンパク質の遺伝子発現変化を引き起こします。[10] ダイナorphinペプチドは、報酬経路を一時的に抑制することで、NAccへのドーパミン放出を減少させます。[10] したがって、CREB の持続的な活性化により、同じ効果を得るためにより多くの薬物を摂取する必要が生じる。[10] さらに、使用者は全般的に抑うつ状態になり、不満を感じ、以前は楽しんでいた活動にも喜びを見出せなくなり、多くの場合、再び薬物を摂取することになる。 [11] CREB に加えて、ストレスメカニズムも依存に関与しているとの仮説がある。KoobとKreekは、薬物使用中にCRFが視床下部-下垂体-副腎軸(HPA軸) および扁桃体拡張部における他のストレス系を活性化すると仮説を立てた。この活性化は、心理的依存に関連する感情の調節障害に影響を与える。彼らは、薬物 使用がエスカレートするにつれ、ヒトの髄液中のCRFの濃度も増加することを発見した。ラットモデルでは、CRF阻害剤とCRF受容体拮抗剤の単独使用 が、研究対象薬物の自己投与を減少させた。本レビューの他の研究では、HPA軸に影響を与える他の神経ペプチドの調節障害が示され、そのうちの一つは痛み を調節する内因性オピオイドペプチドであるエンケファリンが含まれる。また、エンケファリンが作用するμオピオイド受容体は、報酬系に影響を及ぼし、スト レスホルモンの発現を調節する役割を果たすことが示唆されている。[12] 側坐核 MSN における AMPA 受容体の発現増加は、薬物離脱によって生じる嫌悪反応の潜在的なメカニズムである。[13] |
| Methods for reducing dependence A study examined how rats experienced morphine withdrawal in different surroundings. The rats were either placed in a standard environment (SE) or in an enriched environment (EE). The study concluded that EE reduced depression and anxiety withdrawal symptoms.[14] Another study tested whether swimming exercises affected the intensity of perceivable psychological symptoms in rodents during morphine withdrawal. It concluded that the anxious and depressive states of the withdrawal were reduced in rats from the exercise group.[15] |
依存を軽減する方法 ある研究では、異なる環境下でラットがモルヒネ離脱をどのように経験するかを調べた。ラットは、標準環境(SE)またはエンリッチド環境(EE)のいずれかに置かれた。この研究では、EE がうつ病や不安の離脱症状を軽減すると結論付けられた。[14] 別の研究では、モルヒネ離脱中のげっ歯類において、水泳運動が知覚可能な心理的症状の強さに影響を与えるかどうかを検証した。その結果、運動群のラットでは、離脱に伴う不安や抑うつ状態が軽減されたことがわかった。[15] |
| Distinction between psychological and physical dependence The defining contrast between psychological dependence and physical dependence syndromes lies in the nature of the withdrawal symptoms experienced from removal of a particular stimulus following the development of tolerance.[4][10] Psychological dependence is characterized by symptoms that are cognitive in nature and may include anxiety, dysphoria, exhaustion, hyperphagia, or irritability, among other symptoms.[4][5] Conversely, physical dependence involves entirely somatic symptoms, such as diarrhea, myalgia, nausea, sweating, tremors, and other symptoms that are readily observable.[4][17] Substance dependence is a general term that can refer to either psychological or physical dependence, or both, depending on the specific substance involved.[4] 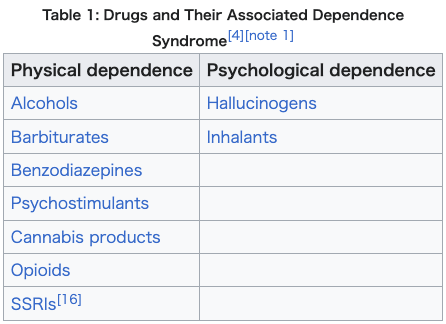 |
心理的依存と身体的依存の区別 心理的依存と身体的依存の症候群の決定的な違いは、耐性の発達後に特定の刺激が除去されたときに生じる離脱症状の性質にある[4][10]。心理的依存 は、認知的な症状を特徴とし、不安、不快感、倦怠感、過食、過敏性などの症状が見られる。[4][5] 一方、身体的依存は、下痢、筋肉痛、吐き気、発汗、震えなど、容易に観察可能な身体的な症状のみを伴う。[4][17] 物質依存は、関与する物質の種類に応じて、心理的依存、身体的依存、またはその両方を指す一般的な用語である。[4]  |
| Compulsion loop Emotional security Habituation Substance dependence Substance use disorder |
強迫ループ 感情の安定 慣れ 物質依存 物質使用障害 |
| Malenka
RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and
Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular
Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.).
New York: McGraw-Hill Medical. pp. 364–375. ISBN 9780071481274. Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues in Clinical Neuroscience. 15 (4): 431–443. PMC 3898681. PMID 24459410. Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict. Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". New England Journal of Medicine. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013. Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe. Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder. Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 16: Reinforcement and Addictive Disorders". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706. Dependence is defined as an adaptive state that develops in response to repeated drug administration, and is unmasked during withdrawal, which occurs when drug taking stops. Dependence resulting from long-term drug use may have both a somatic component, manifested by physical symptoms, and an emotional–motivational component, manifested by dysphoria and anhedonic symptoms, that occur when a drug is discontinued. While physical dependence and withdrawal occur dramatically with some drugs of abuse (opiates, ethanol), these phenomena are not useful in the diagnosis of an addiction because they do not occur as robustly with other drugs of abuse (cocaine, amphetamine) and can occur with many drugs that are not abused (propranolol, clonidine). The official diagnosis of drug addiction by the Diagnostic and Statistical Manual of Mental Disorders (2013), which uses the term substance use disorder, is flawed. Criteria used to make the diagnosis of substance use disorders include tolerance and somatic dependence/withdrawal, even though these processes are not integral to addiction as noted. ... As previously discussed, cessation of cocaine use and the use of other psychostimulants in dependent individuals does not produce a physical withdrawal syndrome but may produce dysphoria, anhedonia, and an intense desire to reinitiate drug use. ... Long-term caffeine use can lead to mild physical dependence. Nestler EJ (2013). "Cellular basis of memory for addiction". Dialogues in Clinical Neuroscience. 15 (4): 431–443. doi:10.31887/DCNS.2013.15.4/enestler. PMC 3898681. PMID 24459410. Stimulant and opiate drugs of abuse activate CREB in several brain regions important for addiction, including prominently in the NAc. ... Drug activation of CREB in NAc has been shown to represent a classic negative feedback mechanism, whereby CREB serves to reduce an animal's sensitivity to the rewarding effects of these drugs (tolerance) and to mediate a negative emotional state during drug withdrawal (dependence). These effects have been shown recently to drive increased drug self-administration and relapse, presumably through a process of negative reinforcement. Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101. Koob, George F.; Le Moal, Michel (2008). "Addiction and the brain antireward system". Annual Review of Psychology. 59: 29–53. doi:10.1146/annurev.psych.59.103006.093548. ISSN 0066-4308. PMID 18154498. Weinstein AA, Koehmstedt C, Kop WJ (November 2017). "Mental health consequences of exercise withdrawal: A systematic review". General Hospital Psychiatry. 49: 11–18. doi:10.1016/j.genhosppsych.2017.06.001. ISSN 1873-7714. PMID 28625704. Results showed a consistent pattern for adverse effects of exercise withdrawal on these mental health measures, particularly depressive symptoms and anxiety. For the studies reviewed, depressive symptoms consistently occurred following the cessation of exercise. Depressive symptoms includes a variety of complaints, including fatigue, tension, confusion, lower self-esteem, insomnia, and irritability. However, the severity of these symptoms did not reach the level of a clinical diagnosis. Exercise deprivation also consistently resulted in an increase in general anxiety (state anxiety), but no information was provided regarding anxiety disorders based on clinical diagnostic criteria. Regarding general mood symptoms and general well-being, results indicated consistent negative changes in both general mood and wellbeing. The most frequently reported feelings were guilt, irritability, anger, confusion, restlessness, tension, frustration, stress, and sluggishness (loss of vigor). Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706. Cognitive control is impaired in several disorders, including attention deficit hyperactivity disorder (ADHD), which is treated with psychostimulants, a term used to describe indirect DA agonists such as methylphenidate and amphetamines that block DAT or cause reverse transport of DA into synapses Hyman SE, Malenka RC, Nestler EJ (2006). "Neural mechanisms of addiction: the role of reward-related learning and memory". Annual Review of Neuroscience. 29: 565–598. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597. For example, withdrawal from opiates or ethanol can produce serious physical symptoms including flu-like symptoms and painful abdominal cramps (opiates) or hypertension, tremor, and seizures (alcohol). In contrast, physical withdrawal symptoms do not occur following cessation of cocaine or amphetamine use. AJ Giannini, RQ Quinones, DM Martin. Role of beta-endorphin and cAMP in addiction and mania. Society for Neuroscience Abstracts. 15:149, 1998. Koob G, Kreek MJ (August 2007). "Stress, dysregulation of drug reward pathways, and the transition to drug dependence". The American Journal of Psychiatry. 164 (8): 1149–59. doi:10.1176/appi.ajp.2007.05030503. PMC 2837343. PMID 17671276. Carlezon WA, Thomas MJ (2009). "Biological substrates of reward and aversion: a nucleus accumbens activity hypothesis". Neuropharmacology. 56 (Suppl 1): 122–32. doi:10.1016/j.neuropharm.2008.06.075. PMC 2635333. PMID 18675281. Hammami-Abrand Abadi, Arezoo; Miladi-Gorji, Hossein; Bigdeli, Imanollah (April 2016). "Effect of environmental enrichment on physical and psychological dependence signs and voluntary morphine consumption in morphine-dependent and morphine-withdrawn rats". Behavioural Pharmacology. 27 (2 and 3 - Special Issue): 270–278. doi:10.1097/fbp.0000000000000197. ISSN 0955-8810. PMID 26397757. S2CID 11212134. Fadaei, Atefeh; Gorji, Hossein Miladi; Hosseini, Shahrokh Makvand (2015-01-15). "Swimming reduces the severity of physical and psychological dependence and voluntary morphine consumption in morphine dependent rats". European Journal of Pharmacology. 747: 88–95. doi:10.1016/j.ejphar.2014.11.042. ISSN 1879-0712. PMID 25498794. Fornaro M, Cattaneo CI, De Berardis D, Ressico FV, Martinotti G, Vieta E (2023). "Antidepressant discontinuation syndrome: A state-of-the-art clinical review". European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 66: 1–10. doi:10.1016/j.euroneuro.2022.10.005. hdl:2445/208551. PMID 36345093. Volkow ND, Bianco C (2020-01-02). "Medications for opioid use disorders: clinical and pharmacological considerations". The Journal of Clinical Investigation. 130 (1): 10–13. doi:10.1172/JCI134708. PMC 6934219. PMID 31763992. |
Malenka
RC、Nestler EJ、Hyman SE (2009). 「第 15 章:強化と依存症」 Sydor A、Brown RY (編).
分子神経薬理学:臨床神経科学の基礎 (第 2 版). ニューヨーク: McGraw-Hill Medical. pp. 364–375.
ISBN 9780071481274. Nestler EJ (2013年12月). 「依存症の記憶の細胞基盤」. Dialogues in Clinical Neuroscience. 15 (4): 431–443. PMC 3898681. PMID 24459410. 数多くの心理社会的要因の重要性にもかかわらず、薬物依存症の核心には生物学的プロセスが存在します:薬物乱用物質への反復曝露が、薬物の強迫的な探索と 摂取を駆動し、薬物使用の制御喪失を引き起こす脆弱な脳の変化を引き起こす能力です。これが依存症の状態を定義します。... 多くの研究は、D1型[腹側被蓋野]神経細胞におけるΔFosBの誘導が、動物の薬物および自然報酬に対する感受性を高め、薬物自己投与を促進することを 示している。これはおそらく、正の強化プロセスを通じて起こるものと考えられる... ΔFosBのもう一つの標的はcFosです:ΔFosBが薬物曝露の繰り返しで蓄積すると、c-Fosを抑制し、慢性的な薬物曝露状態においてΔFosB が選択的に誘導される分子スイッチに寄与します。41. ... さらに、人口全体にわたり依存症の遺伝的リスクが存在するにもかかわらず、十分な高用量の薬物を長期間曝露することで、遺伝的負荷が比較的低い個体を依存 症に変える可能性があるという証拠が増加している。 Volkow ND, Koob GF, McLellan AT (January 2016). 「Neurobiologic Advances from the Brain Disease Model of Addiction」. New England Journal of Medicine. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013。物質使用障害:精神障害の診断と統計マニュアル(DSM-5)の第 5 版における診断用語で、臨床的および機能的に重大な障害(健康問題、障害、職場、学校、家庭での重要な責任の遂行不能など)を引き起こす、アルコールやそ の他の薬物の反復使用を指す。重症度に応じて、この障害は軽度、中等度、重度に分類される。 依存症:物質使用障害の最も重度で慢性的な段階を指す用語で、薬物の使用を止めたいという願望にもかかわらず、強迫的な薬物使用が見られるなど、自己制御の著しい喪失が特徴。DSM-5では、依存症という用語は重度の物質使用障害の分類と同義。 Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). 「Chapter 16: Reinforcement and Addictive Disorders」. Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706。 依存は、反復的な薬物投与に対して発達する適応状態であり、薬物使用を中止した際に現れる離脱症状によって明らかになる。長期的な薬物使用による依存は、 身体症状として現れる身体的成分と、薬物使用を中止した際に現れる不快感や快楽喪失症状として現れる情動・動機付け的成分の両方を有する場合がある。身体 的依存と離脱は、一部の乱用薬物(オピオイド、エタノール)では劇的に現れるが、これらの現象は、他の乱用薬物(コカイン、アンフェタミン)ではそれほど 明確に現れないため、依存症の診断には有用ではない。また、乱用されない多くの薬物(プロプラノロール、クロニジン)でもこれらの現象は現れる。精神障害 の診断と統計マニュアル(2013年)で「物質使用障害」という用語を使用して行われる薬物依存症の公式診断は不備がある。物質使用障害の診断基準には、 耐性と身体的依存/離脱が含まれているが、これらのプロセスは依存症の本質的な要素ではないことが指摘されている。... 前述のように、依存症患者におけるコカインの使用中止や他の心理刺激薬の使用は、身体的離脱症候群を引き起こさないが、不快感、無快感、および薬物使用を再開したいという強い欲求を引き起こす可能性がある。... 長期的なカフェインの使用は、軽度の身体的依存を引き起こす可能性がある。 Nestler EJ (2013). 「Cellular basis of memory for addiction」. Dialogues in Clinical Neuroscience. 15 (4): 431–443. doi:10.31887/DCNS.2013.15.4/enestler. PMC 3898681. PMID 24459410. 刺激薬とオピオイド薬物は、依存症に重要な脳領域の複数でCREBを活性化し、特にNAcで顕著に活性化される。 ... NAcにおけるCREBの薬物活性化は、古典的な負のフィードバックメカニズムを表すことが示されており、CREBはこれらの薬物の報酬効果に対する動物 の感受性を低下させる(耐性)とともに、薬物離脱時の負の感情状態を仲介する。これらの効果は最近、負の強化プロセスを通じて薬物の自己投与増加と再発を 促進することが示されている。 Olsen CM (2011年12月). 「Natural rewards, neuroplasticity, and non-drug addictions」. Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101. Koob, George F.; Le Moal, Michel (2008). 「依存症と脳の報酬抑制システム」. Annual Review of Psychology. 59: 29–53. doi:10.1146/annurev.psych.59.103006.093548. ISSN 0066-4308. PMID 18154498. Weinstein AA、Koehmstedt C、Kop WJ (2017年11月)。「運動中止による精神的健康への影響:系統的レビュー」。General Hospital Psychiatry. 49: 11–18. doi:10.1016/j.genhosppsych.2017.06.001. ISSN 1873-7714. PMID 28625704。結果は、これらのメンタルヘルスの指標、特に抑うつ症状と不安に対して、運動中止が有害な影響を及ぼすという一貫したパターンを示し た。レビューした研究では、運動中止後に一貫して抑うつ症状が見られた。抑うつ症状には、疲労、緊張、混乱、自尊心の低下、不眠、過敏性など、さまざまな 症状がある。しかし、これらの症状の重症度は臨床診断のレベルには達しなかった。運動の制限は、一般不安(状態不安)の増加を一貫して引き起こしたが、臨 床診断基準に基づく不安障害に関する情報は提供されていなかった。一般気分症状と一般幸福感に関しては、一般気分と幸福感の両方で一貫した負の変化が示さ れた。最も頻繁に報告された感情は、罪悪感、イライラ、怒り、混乱、落ち着きのなさ、緊張、不満、ストレス、および活力の低下(活力の喪失)だった。 Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). 「Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin」. Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706。認知制御は、注意欠如多動症(ADHD)を含む複数の障害で障害を受ける。ADHDは、メチルフェニデートやアンフェタミン などのドーパミンアセチル転送タンパク質(DAT)を阻害したり、ドーパミンをシナプス内に逆輸送させたりする間接的なドーパミンアゴニストである心理刺 激薬で治療される。Hyman SE, Malenka RC, Nestler EJ (2006). 「依存症の神経メカニズム:報酬関連学習と記憶の役割」。Annual Review of Neuroscience. 29: 565–598. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597。例えば、アヘン剤やエタノールを摂取を止めると、インフルエンザのような症状や激しい腹痛(アヘン剤)や高血圧、震え、発作(アルコー ル)などの深刻な身体症状が現れることがある。一方、コカインやアンフェタミンの使用を止めると、身体的な離脱症状は現れない。 AJ Giannini、RQ Quinones、DM マーティン。依存症および躁病におけるβ-エンドルフィンおよび cAMP の役割。神経科学学会抄録集。15:149、1998。 Koob G、Kreek MJ (2007年8月)。「ストレス、薬物報酬経路の調節機能障害、および薬物依存への移行」。The American Journal of Psychiatry(アメリカ精神医学雑誌)。164 (8): 1149–59. doi:10.1176/appi.ajp.2007.05030503. PMC 2837343. PMID 17671276. Carlezon WA, Thomas MJ (2009). 「報酬と嫌悪の生物学的基盤:腹側被蓋核活動仮説」. Neuropharmacology. 56 (Suppl 1): 122–32. doi:10.1016/j.neuropharm.2008.06.075. PMC 2635333. PMID 18675281. Hammami-Abrand Abadi, Arezoo; Miladi-Gorji, Hossein; Bigdeli, Imanollah (2016年4月). 「環境エンリッチメントがモルヒネ依存性およびモルヒネ離脱ラットの身体的・心理的依存症状および自発的モルヒネ摂取に与える影響」. 行動薬理学. 27 (2と3 - 特別号): 270–278. doi:10.1097/fbp.0000000000000197. ISSN 0955-8810. PMID 26397757. S2CID 11212134. ファダイ、アテフェ;ゴルジ、ホセイン・ミラディ;ホセイン、シャホルク・マクヴァンダ(2015年1月15日)。「水泳は、モルヒネ依存ラットの身体的 および心理的依存の重症度と自発的なモルヒネ摂取量を軽減する」。European Journal of Pharmacology. 747: 88–95. doi:10.1016/j.ejphar.2014.11.042. ISSN 1879-0712. PMID 25498794. フォルナロ M、カッタネオ CI、デ・ベラルディス D、レッシコ FV、マルティノッティ G、ヴィエタ E(2023)。「抗うつ薬離脱症候群:最新の臨床的レビュー」。European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 66: 1–10. doi:10.1016/j.euroneuro.2022.10.005. hdl:2445/208551. PMID 36345093. Volkow ND, Bianco C (2020-01-02). 「オピオイド使用障害の治療薬:臨床的および薬理学的考察」. The Journal of Clinical Investigation. 130 (1): 10–13. doi:10.1172/JCI134708. PMC 6934219. PMID 31763992. |
| https://en.wikipedia.org/wiki/Psychological_dependence |
|
リ ンク
文 献
そ の他の情報
Copyleft,
CC, Mitzub'ixi Quq Chi'j, 1996-2099
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099
☆
 ☆
☆